|
|
|||
|
|||
|
ГЛАВА 5
5.3. Принцип детального равновесия |
|
Статистическое описание равновесных состояний может быть выполнено с использованием предположения о том, что в равновесной термодинамической системе два любых противоположно направленных процесса должны компенсировать друг друга. Если указанное предположение не выполняется, то это приведет к возникновению в системе упорядоченных движений или процессов, и ее состояние станет неравновесным.
Требование взаимной компенсации двух любых противоположно направленных процессов можно выразить в виде принципа детального равновесия:
В равновесной термодинамической системе вероятности протекания прямого и обратного процессов одинаковые.
Данная формулировка справедлива для любых, в том числе и микроскопических процессов, имеющих очень малые пространственный размеры. Под обратным процессом понимается такой процесс, который полностью совпадает с прямым при замене течения времени на противоположное. Например, если прямой процесс заключается в соударении двух шаров, при котором их начальные скорости
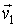 и и 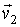 переходят в переходят в 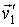 и и 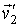 , то при обратном процессе произойдет обратный переход скоростей , то при обратном процессе произойдет обратный переход скоростей 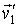 и и 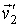 в в 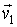 и и 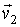 . .Рассмотрим применение принципа детального равновесия для нахождения функции распределения по скоростям молекул идеального газа, находящегося в состоянии термодинамического равновесия в отсутствии внешнего поля. Этот вывод был впервые предложен в 1866 году английским физиком Джеймсом Клерком Максвеллом (1831 - 1879). Для простоты будем считать, что молекулы газа представляют собой упругие шары, и при их соударении выполняются законы сохранения импульса и кинетической энергии:
где
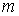 - масса молекулы. - масса молекулы.Далее будем считать начальные скорости молекул
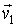 и и 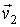 статистически независимыми друг от друга. Данное предположение является достаточно обоснованным для рассматриваемого случая хаотического движения молекул идеального газа. Вероятность того, что при столкновении молекул их скорости станут равными статистически независимыми друг от друга. Данное предположение является достаточно обоснованным для рассматриваемого случая хаотического движения молекул идеального газа. Вероятность того, что при столкновении молекул их скорости станут равными 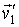 и и 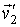 определяется вероятностью наличия у них перед столкновением скоростей определяется вероятностью наличия у них перед столкновением скоростей 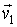 и и 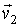 . Эта вероятность, в соответствии с формулами (5.9) и (5.10), может быть определена следующим образом: . Эта вероятность, в соответствии с формулами (5.9) и (5.10), может быть определена следующим образом:
где:
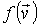 - искомая функция распределения скоростей молекул газа, - искомая функция распределения скоростей молекул газа, 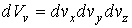 - элементарный объем в пространстве скоростей. В пространстве скоростей координаты молекулы задаются значениями проекций её скорости - элементарный объем в пространстве скоростей. В пространстве скоростей координаты молекулы задаются значениями проекций её скорости 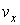 , , 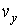 и и 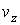 , которые откладываются по соответствующим осям прямоугольной системы координат (см. параграф 5.4). , которые откладываются по соответствующим осям прямоугольной системы координат (см. параграф 5.4).Соответственно вероятность обратного процесса определяется вероятностью того, что при этом процессе в начале скорости молекул имели значения
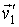 и и 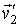 : :
В соответствии с принципом детального равновесия вероятность прямого и обратного процессов должна быть одинакова:
или
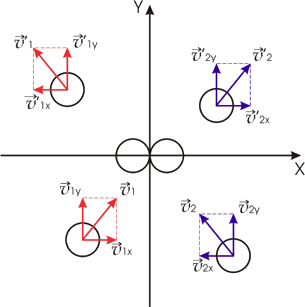
Рассмотрим более подробно процесс соударения двух шаров, который для упрощения рисунка схематически изображен на рис. 5.2 в двумерной системе координат. Для определенности будем считать, что ось 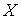 направлена по линии, соединяющей центры шаров в момент удара. направлена по линии, соединяющей центры шаров в момент удара.
При абсолютно упругом соударении двух одинаковых шаров они обмениваются значениями проекций их скоростей на ось, параллельную линии, соединяющей их центры (в данном случае на ось
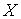 ), и сохраняют значения проекций скоростей на другие оси ), и сохраняют значения проекций скоростей на другие оси 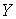 и и 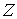 : : 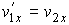 , , 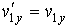 , ,
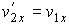 , , 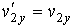 , ,
Отсюда следует, что и дифференциалы от соответствующих проекций скоростей должны преобразовываться по аналогичным формулам:
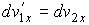 , , 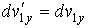 , ,
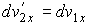 , , 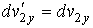 , ,
Перемножение всех этих выражений дает
или
С учетом этой формулы выражение (5.29) принимает вид
Полученное соотношение (5.36) является исходным для построения функции распределения по скоростям для газа, находящегося в состоянии термодинамического равновесия. Причем, указанное соотношение справедливо не только для рассмотренного модельного случая молекул в виде упругих шаров, но и для молекул произвольной формы. Это связано с тем, что оно может быть доказано на основе обратимости во времени законов механики.
При проведении дальнейших преобразований учтем свойство симметрии функции распределения по отношению к изменению направления скорости молекулы
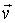 на противоположное: на противоположное:
которое связано с равноправностью положительных и отрицательных направлений осей в пространстве. Отсюда следует, что функция
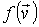 должна зависеть только от величины скорости молекулы и не зависеть от направления вектора её скорости. По этой причине далее в выражениях для функции распределения будем опускать значок вектора над скоростью молекулы. должна зависеть только от величины скорости молекулы и не зависеть от направления вектора её скорости. По этой причине далее в выражениях для функции распределения будем опускать значок вектора над скоростью молекулы.Прологарифмируем выражение (5.36)
и сравним полученное выражение с формулой, являющейся следствием закона сохранения кинетической энергии (5.25):
Сопоставление выражений (5.38) и (5.39) с учетом требования симметрии функции распределения (5.37) приводит к однозначному виду для искомой функции распределения:
или
где постоянные
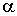 и и 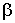 должны определяться из дополнительных физических соображений. должны определяться из дополнительных физических соображений.В заключении необходимо отметить, что принцип детального равновесия позволяет не только определять вид равновесных функций распределения для газов, описываемых классической механикой, но и применим для описания квантовомеханических систем, в частности, электронного газа.
|
|
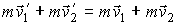 ,
,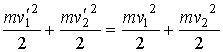 ,
,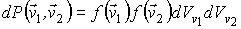 ,
,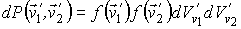 .
.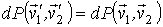
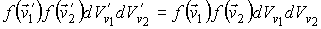 .
.
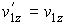 ,
,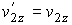 .
.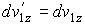 ,
,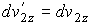 .
.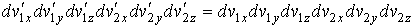
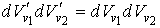 .
.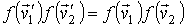 .
.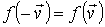 ,
,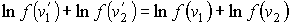
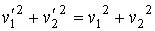 .
.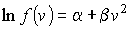
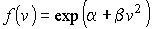 ,
,