|
|
|||
|
|||
|
ГЛАВА 3
3.8. Термодинамическая энтропия |
|
Понятие термодинамической энтропии, впервые введенное в 1865 году Клаузиусом, имеет ключевое значение для понимания основных положений термодинамики.
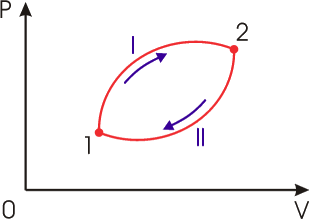
Рассмотрим обратимый круговой термодинамический процесс, представленный на рис. 3.9. Для этого процесса может быть записано равенство Клаузиуса (3.49) в виде
где первый интеграл берется по траектории  , а второй - соответственно по траектории , а второй - соответственно по траектории  . .
Изменение направления протекания процесса
 на противоположное на противоположное  , что можно выполнить вследствие обратимости процесса , что можно выполнить вследствие обратимости процесса  , приводит к замене знака перед вторым интегралом формулы (3.50). Выполнение этой замены и перенос второго интеграла в выражении (3.50) в правую часть дают , приводит к замене знака перед вторым интегралом формулы (3.50). Выполнение этой замены и перенос второго интеграла в выражении (3.50) в правую часть дают
Из полученного выражения следует, что для обратимых процессов интеграл
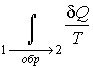 не зависит от конкретного вида траектории, по которой происходит процесс, а определяется только начальным и конечным равновесными состояниями термодинамической системы. не зависит от конкретного вида траектории, по которой происходит процесс, а определяется только начальным и конечным равновесными состояниями термодинамической системы.С аналогичной ситуацией мы уже встречались, когда в механике рассматривали определение работы консервативной силы. Независимость работы консервативной силы от формы траектории движения тела позволила ввести функцию, названную потенциальной энергией, которая зависит только от состояния механической системы и не зависит от того, как в это состояние система была переведена.
Из этой аналогии следует, что элементарное приведенное количество теплоты
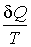 должно представлять собой полный дифференциал некоторой функции должно представлять собой полный дифференциал некоторой функции 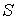 , зависящей только от состояния термодинамической системы, то есть: , зависящей только от состояния термодинамической системы, то есть:
Тогда интеграл
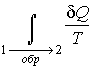 будет равен разности значений функции будет равен разности значений функции 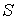 в равновесных состояниях 1 и 2: в равновесных состояниях 1 и 2:
Итак, величина
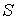 является функцией, зависящей только от равновесного состояния термодинамической системы. Она не зависит от конкретного вида термодинамического процесса, приведшего систему в указанное состояние. Эта функция была названа Клаузиусом термодинамической энтропией. Выражения (3.52) и (3.53) дают математическую формулировку сформулированного выше определения термодинамической энтропии. является функцией, зависящей только от равновесного состояния термодинамической системы. Она не зависит от конкретного вида термодинамического процесса, приведшего систему в указанное состояние. Эта функция была названа Клаузиусом термодинамической энтропией. Выражения (3.52) и (3.53) дают математическую формулировку сформулированного выше определения термодинамической энтропии.Из выражения (3.53) следует, что термодинамическая энтропия, так же как и потенциальная энергия, определяется с точностью до произвольной постоянной. Это связано с тем, что формула (3.53) не позволяет определить абсолютное значение термодинамической энтропии, а дает только разность энтропий для двух равновесных состояний, как суммарную приведенную теплоту в обратимом термодинамическом процессе, переводящим систему из одного состояния в другое.
Задача 3.4. Жесткий теплоизолированный сосуд объемом
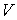 разделен на две части с помощью перегородки. В начальный момент с одной стороны перегородки в объеме разделен на две части с помощью перегородки. В начальный момент с одной стороны перегородки в объеме 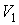 находится находится 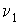 молей идеального газа с теплоемкостью молей идеального газа с теплоемкостью 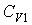 при температуре при температуре 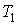 , а с другой стороны - в объеме , а с другой стороны - в объеме 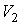 ( (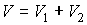 ) находится ) находится 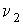 молей другого идеального газа с теплоемкостью молей другого идеального газа с теплоемкостью 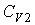 при температуре при температуре 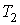 . Перегородку медленно удаляют, что приводит к смешиванию газов и выравниванию их температуры. Определить изменение энтропии в этом процессе. . Перегородку медленно удаляют, что приводит к смешиванию газов и выравниванию их температуры. Определить изменение энтропии в этом процессе.Решение: Так как сосуд является жестким и теплоизолированным, то можно считать, что суммарная внутренняя энергия системы не изменяется. Тогда установившуюся температуру можно найти из соотношения:
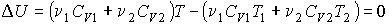 . .Отсюда имеем:
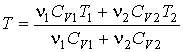 . .Будем считать, что рассматриваемый процесс смешивания газов и выравнивания их температур является квазиравновесным. Тогда в соответствии с формулой (3.52) и первым началом термодинамики можно записать
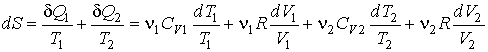 . . Интегрирование этого выражения в соответствии с формулой (2.53) дает:
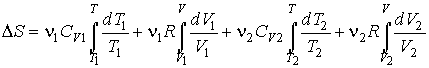 или после вычисления интегралов имеем
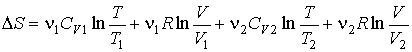 . .В частном случае, если
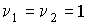 и и 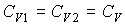 имеем: имеем: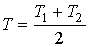 , ,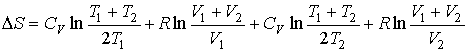 . .Если
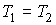 и и 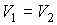 , то , то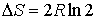 . .Таким образом, при смешивании двух газов энтропия системы увеличивается как вследствие выравнивания их температуры, так и за счет их взаимного перемешивания. Оба эти процесса являются необратимыми, что и описывается возрастанием суммарной энтропии системы
|
|
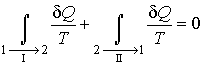 ,
,
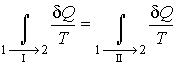 .
.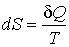 .
.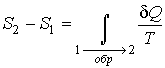 .
.