|
|
|||
|
|||
|
ГЛАВА 4
4.5. Краткое введение в термодинамику необратимых процессов |
|
Применение законов равновесной термодинамики ограничено случаем, когда температура
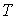 , давление , давление 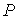 и другие параметры состояния во всех точках системы одинаковы. Если это не так, то в термодинамической системе возникают необратимые процессы. и другие параметры состояния во всех точках системы одинаковы. Если это не так, то в термодинамической системе возникают необратимые процессы.Для описания необратимых процессов можно воспользоваться гипотезой локального равновесия, заключающейся в предположении, что внутри малого объема среды выполняется основное уравнение термодинамики равновесных процессов. Если в качестве параметров состояния ввести локальную плотность внутренней энергии
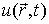 , приходящуюся на единицу массы среды, и удельный объем , приходящуюся на единицу массы среды, и удельный объем 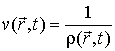 , то для точки среды с координатами , то для точки среды с координатами 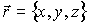 в момент времени в момент времени 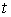 можно записать уравнение можно записать уравнение
где:
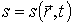 - локальная плотность энтропии на единицу массы среды, - локальная плотность энтропии на единицу массы среды, 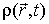 - локальная плотность среды. - локальная плотность среды.Тогда внутренняя энергия
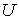 всей системы определяется с помощью выражения всей системы определяется с помощью выражения
а ее энтропия
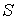 соответственно может быть найдена по формуле соответственно может быть найдена по формуле
Совместное применение уравнения (4.73) с уравнениями баланса массы, внутренней энергии и других термодинамических величин, позволяет построить феноменологическую термодинамику необратимых процессов.
Ключевое значение в неравновесной термодинамике имеет величина, численно равная скорости увеличения энтропии в единице объема:
Эта величина
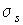 представляет собой производство энтропии для единичного объема адиабатически изолированной системы. представляет собой производство энтропии для единичного объема адиабатически изолированной системы.Если в качестве термодинамических параметров системы выступают
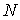 величин величин 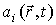 , то формулу (4.76) можно представить в виде: , то формулу (4.76) можно представить в виде:
Величины
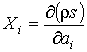 называются термодинамическими силами, а величины называются термодинамическими силами, а величины 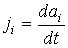 - плотностями термодинамических потоков. Следовательно, производство энтропии - плотностями термодинамических потоков. Следовательно, производство энтропии 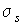 можно определить по формуле: можно определить по формуле:
В случае небольших отклонений от равновесного состояния между термодинамическими потоками
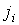 и термодинамическими силами и термодинамическими силами 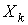 может быть установлена линейная зависимость может быть установлена линейная зависимость
Это соответствует наиболее простому случаю линейной термодинамики.
Таким образом, для линейной термодинамики производство энтропии определяется выражением
или
Коэффициенты
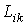 называются кинетическими коэффициентами, и они характеризуют интенсивность явлений переноса. В 1931 году американский физик и химик Ларс Онсагер (1903 - 1976) установил, что для кинетических коэффициентов выполняется условие: называются кинетическими коэффициентами, и они характеризуют интенсивность явлений переноса. В 1931 году американский физик и химик Ларс Онсагер (1903 - 1976) установил, что для кинетических коэффициентов выполняется условие:
указывающее на симметрию матрицы кинетических коэффициентов. Выражение (4.82) называется соотношением взаимности Онсагера.
Одним из принципов линейной неравновесной термодинамики является предложенный в 1947 году бельгийским физико-химиком Ильей Романовичем Пригожиным (р. 1917) принцип минимума производства энтропии:
Стационарные необратимые процессы протекают таким образом, чтобы производство энтропии было минимальным.
Принцип Пригожина позволяет установить какие процессы реализуются в природе, а какие нет, и, таким образом, выбрать из возможных процессов реально существующие.
Необходимость выполнения указанного принципа приводит к тому, что при протекании в среде необратимых стационарных процессов возникают динамические структуры, названные Пригожиным диссипативными структурами, что уменьшает производство энтропии. Примером таких структур могут служить ячейки Бенара - регулярные динамические структуры, возникающие в тонком слое нагреваемой снизу жидкости, и колебательные химические реакции Б.П. Белоусова, при которых происходят периодические изменения концентрации реагирующих веществ.
|
|
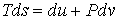 ,
,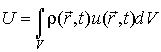 ,
,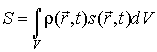 .
.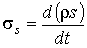 .
.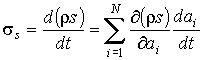 .
.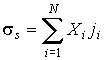 .
.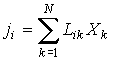 .
.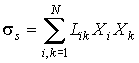
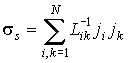 .
.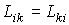 ,
,