1.2. Физические механизмы образования кристаллов.
В настоящее время известны тысячи кристаллических веществ, это и сравнительно простые металлы и их сплавы и кристаллы со сложной структурой, уникальные свойства которых обусловлены особым расположением большого числа атомов. Между тем состоят все эти кристаллы всего из нескольких десятков сортов атомов, но по-разному расположенных относительно друг друга. Известно, что электромагнитное взаимодействие между атомами заставляет атомы объединяться и формировать разные типы кристаллической решетки. В этом процессе главную роль играет электростатическая энергия взаимодействия зарядов, а в некоторых случаях и энергия магнитного взаимодействия, хотя вклад ее много меньше. Как перечисленные взаимодействия, так и атомные оболочки обладают определенной "симметричностью" и поэтому атомы объединяются как правило в весьма симметричные структуры, главные из которых были рассмотрены в предыдущем разделе. По этой же причине разные, но близкие по характеристикам атомы, формируют кристаллические решетки, в которых атомы расположены идентично. Знание этих общих закономерностей построения кристаллов позволяет часто предсказывать новые структуры и материалы или улучшать физические свойства уже существующих материалов.
В настоящее время по характеру связи атомов выделяют 5 типов кристаллов: 1) ионные кристаллы 2) ковалентные кристаллы, 3) металлические кристаллы, 4) молекулярные кристаллы с водородными связями, 5) Ван-дер-Ваальсовы кристаллы. Все эти типы, кроме последнего играют очень большую роль в природе и в современной технике. Деление это весьма условно, существуют кристаллы которые можно считать переходными между этими типами, встречаются кристаллы в которых часть связей ковалентная, а часть - водородная. Остановимся на них подробнее.
Ионные кристаллы. Ионные кристаллы формируются под влиянием электростатического притяжения разноименно заряженных и отталкивания одноименно заряженных ионов. Типичным примером могут служить вещества 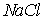  и 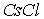 , рассмотренные в разд. 1.1. Каждый положительно заряженный ион ( 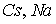 ) стремится окружить себя отрицательно заряженными ионами ( 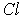 ), а отрицательные ионы окружают себя положительными ионами. Ионы могут сближаться до тех пор пока не начнется перекрытие их электронных облаков, в этом случае появляются силы отталкивания, имеющие квантовую природу. В результате очень часто формируются структуры, изображенные на рис. 1 и 8 . В кристаллах 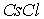 каждый ион окружен восемью ионами противоположного знака, расположенными симметрично и на расстоянии 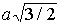 от него; далее на расстоянии 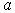 располагаются 6 ионов того же знака, что и рассматриваемый, и так далее. В кристаллах 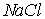 у каждого иона - шесть ближайших соседей - ионов противоположного знака на расстоянии 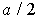 , далее на расстоянии 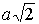 располагаются 12 ионов того же знака и так далее. Видна тенденция, что ближе к выбранному иону оказываются ионы противоположного знака. Такое расположение дает выигрыш в электростатической энергии по сравнению с ионами, удаленными друг от друга.
Рассчитаем выигрыш в электростатической энергии и связанную с ним энергию связи ионов в кристалле. В таких расчетах рассматривают потенциальную энергию парного взаимодействия двух ионов с зарядами 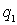 и 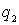 , расположенными на расстоянии 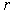 друг от друга:
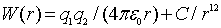 . . | (1.1) |
Первое слагаемое описывает энергию кулоновского притяжения или отталкивания ионов, а второй - весьма точно описывает отталкивание ионов из-за перекрытия их электронных облаков. Параметр 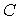 подбирают по результатам соспоставления результатов расчетов с экспериментальными данными. Типичный вид функции 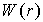 и обоих ее слагаемых представлен на рис. 10. | Рис. 1.10.
Зависимость энергии взаимодействия двух ионов W(r) от расстояния r между ними. |
Далее выбирают один из ионов и суммируют энергии парного взаимодействия выбранного иона и ближайших соседей, более удаленных соседей и так далее. При расчете считают кристалл очень большим и пренебрегают поверхностными эффектами. Вычисленная сумма даст энергию связи выбранного иона в кристалле. Далее, можно найти минимум этой энергии как функции параметра решетки 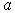 и предсказать равновесное значение 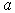 как точку минимума энергии. Также можно вычислить вторую производную вычисленной энергии по 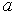 и предсказать величину связанного с ней объемного модуля упругости 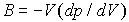 .
Расчеты выполненные по такой схеме, подробно изложенные в [1], при правильном выборе параметра 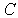 дают весьма точные значения энергии связи, параметра решетки  и модуля 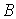 .
Ионные кристаллы как правило имеют сравнительно простые, сильно упакованные и высокосимметричные, например кубические, кристаллические решетки. Эти кристаллы как правило хрупкие.
Ковалентные кристаллы. Ковалентные кристаллы образуются за счет ковалентных связей между атомами. Ковалентная связь образуется за счет перекрытия электронных облаков, в результате между атомами образуется сгусток отрицательного заряда, который стягивает два атома. Атом в зависимости от его валентности может иметь несколько таких связей, расположенных под определенными углами друг к другу. Атомы в ковалентном кристалле соединяются за счет ковалентных связей, причем углы между связями и их "длины" могут слегка отличаться для кристаллов с разной структурой.
Типичным ковалентным кристаллом можно считать алмаз, кристаллическая решетка которого изображена на рис. 9. Можно показать (см. задачу 1.2), что в такой решетке каждый атом окружен четырьмя соседями, расположенными симметрично по углам тетраэдра относительно него. Именно так часто располагаются ковалентные связи атома углерода.
Расчеты энергии связи в случае ковалентных кристаллов достаточно сложны и мы их не рассматриваем.
Кристаллические решетки ковалентных кристаллов и их базисы могут быть весьма сложными и малосимметричными, поскольку формирование кристалла обусловлено ковалентными связями со всевозможной ориентацией между атомами или частями молекул. При рассмотрении ковалентных кристаллов часто пользуются понятиями " ковалентный радиус атома", " длина ковалентной связи" между атомами определенного сорта, углы между связями, поскольку эти величины сравнительно мало меняются в случаях различного окружения этих атомов в кристалле.
Между рассмотренными типами ковалентных и ионных кристаллов имеется много промежуточных типов кристаллов, связь в которых как правило ковалентная полярная. В такой связи сгусток электронной плотности ковалентной связи смещен к одному из ионов, из-за чего появляется дополнительная кулоновская энергия взаимодействия слегка заряженных атомов. Ионная связь как правило появляется между атомами с почти заполненными электронными оболочками (щелочные металлы, элементы первой и седьмой, реже второй и шестой групп таблицы Менделеева). Элементы третьей - пятой групп как правило образуют ковалентные связи. В некоторых случаях удается экспериментально (рассмотренными в следующем разделе дифракционными методами) определить среднее число электронов у атомов в кристаллической решетке и тем самым сделать вывод о заряде атомов и о характере связи в кристалле.
Металлические кристаллы. В металлических кристаллах внешние электроны атомов могут свободно перемещаться между ионными остовами. Эти электроны образуют как бы отрицательно заряженное облако, в котором находятся ионы металла. Взаимодействие этих ионов друг с другом и с электронным облаком ведет к упорядоченному расположению ионов в металле. В случае переходных металлов происходит также и перекрытие их электронных 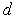 -оболочек и образование подобия ковалентных связей, ведущее к дополнительному увеличению энергии связи в металле. Расчеты энергии связи в металлах достаточно сложны и в данной книге не рассматриваются. Как правило металлы образуют одну из плотноупакованных кристаллических решеток (ГПУ, ГЦК) или ОЦК.
Молекулярные кристаллы с водородными связями. В молекулярных кристаллах с водородными связями водородная связь образуется между отрицательно заряженными атомами 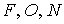 , уже участвующими в полярной ковалентной связи с другими атомами, когда между ними оказывается ион водорода. Один из перечисленных атомов забирает себе электрон водорода, превращая его в предельном случае в протон, которому иногда энергетически выгоднее оказаться между двумя отрицательно заряженными ионами, чем быть связанным только с одним из перечисленных атомов (см. рис. 11). При этом за счет кулоновского притяжения отрицательных ионов к иону водорода образуется сравнительно непрочная связь с энергией порядка 0,1 эВ. Малость иона водорода позволяет последнему связать только два атома. | Рис. 1.11.
Схема образования водородной связи. |
Водородная связь играет важную роль в биологических молекулах и кристаллах. Например соединение двух спиралей ДНК обусловлено водородными связями. Сегнетоэлектрические свойства некоторых кристаллов и поведение молекул воды и льда при температуре около 0 0С объясняют существованием водородных связей в них [1].
Ван-дер-Ваальсовы кристаллы. Ван-дер-Ваальсовы кристаллы образуются из электрически нейтральных атомов за счет диполь - дипольного взаимодействия между ними. Под действием этих связей образуются кристаллы инертных газов при низких температурах, образуя во всех случаях ГЦК плотноупакованную решетку. Эти связи гораздо слабее всех рассмотренных выше и поэтому заметно проявляют себя при отсутствии условий для возникновения ионной, ковалентной металлической или водородной связи. | Рис. 1.12.
Схема образования диполь-дипольной связи. |
Понять происхождение этой связи можно с помощью простой классической модели, рассмотрев взаимодействие двух нейтральных атомов, находящихся на расстоянии 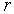 друг от друга (см. рис. 12). Центр отрицательного заряда в каждый момент времени не совпадает с центром положительного ядра атома. Поэтому атом 1 обладает ненулевым мгновенным значением дипольного момента 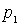 . Этот дипольный момент создает электрическое поле  вблизи атома 2 с модулем
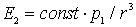 . . | (1.2) |
Это поле поляризует второй атом в результате у него наводится дипольный момент:
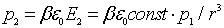 , , | (1.3) |
где 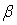 - поляризуемость атома. Энергия взаимодействия двух диполей пропорциональна 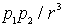 . Тогда энергия взаимодействия двух атомов оказывается пропорциональной  , она имеет малую величину, быстро убывает с расстоянием и проявляется вследствие этого на малых расстояниях. Как и в случае ионных кристаллов можно записать (см. задачу 1.3) энергию взаимодействия двух атомов, добавив к энергии взаимодействия пропорциональной 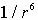 энергию отталкивания атомов пропорциональную 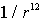 и вычислить энергию образования кристаллической решетки, параметр решетки и модуль упругости. Результаты таких расчетов хорошо согласуются с экспериментальными данными.
Моно- и поликристаллические вещества. Используемые в технике материалы и детали из них сравнительно редко состоят из одной кристаллической решетки. Такие вещества называют монокристаллическими веществами(или монокристаллами), то есть состоящими из одного сплошного кристалла.
Наиболее часто используемые материалы, называемые поликристаллическими состоят из очень большого числа сросшихся друг с другом монокристаллических зерен. Такая структура материала связана с тем, что кристаллизация веществ как правило начинается и проходит одновременно из большого числа центров кристаллизации. Если принять специальные меры [1], то возможно получение монокристаллов или из раствора, или из расплава вещества.
Использование монокристаллических веществ и деталей из них в отдельных случаях является принципиально необходимым, например для изготовления поляризаторов оптического излучения или монохроматоров рентгеновского излучения. В ряде случаев использование монокристаллических веществ значительно улучшает характеристики сделанной из него детали. Примеры такого использования рассмотрены в последующих главах.
Задача 1.3. Оценить энергию связи атома в Ван-дер-Ваальсовом кристалле аргона, расстояние между ближайшими соседями при 0 0К и температуру его плавления, если потенциальная энергия взаимодействия между его атомами задается соотношением: 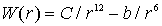 . При расчете учитывать только энергии взаимодействия с ближайшими соседями и считать что структура аргона - ГЦК решетка.
Решение. Энергия взаимодействия атома с 12 ближайшими соседями в ГЦК решетке дается формулой 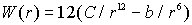 . Далее следует найти минимум этого выражения по расстоянию между атомами традиционным способом: вычислить производную, найти значение 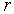 , при котором она равна нулю, определить минимальное значение 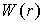 . Разделив это значение на постоянную Больцмана, можно получить оценку температуры плавления.
|