4.5. Введение в термодинамику необратимых процессов
Применение законов равновесной термодинамики ограничено случаем, когда температура 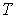 , давление 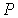 и другие параметры состояния во всех точках системы одинаковы. Если это не так, то в термодинамической системе возникают необратимые процессы.
Для описания необратимых процессов можно воспользоваться гипотезой локального равновесия, заключающейся в предположении, что внутри малого объема среды выполняется основное уравнение термодинамики равновесных процессов. Если в качестве параметров состояния ввести локальную плотность внутренней энергии 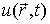 , приходящуюся на единицу массы среды, и удельный объем 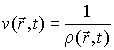 , где 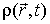 - локальная плотность среды, то для точки среды с координатами 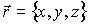 в момент времени 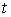 можно записать уравнение
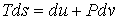 . . | (4.82) |
Здесь 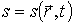 - удельная энтропия на единицу массы среды.
Тогда внутренняя энергия 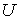 всей системы определяется с помощью выражения
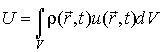 , , | (4.83) |
а ее энтропия 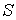 соответственно может быть найдена по формуле
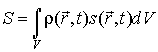 . . | (4.84) |
Совместное применение уравнения (4.82) с уравнениями баланса массы, внутренней энергии и других термодинамических величин, позволяет построить феноменологическую термодинамику необратимых процессов, опирающуюся на использование полученных из опыта соотношений между параметрами, описывающими термодинамические процессы.
Ключевое значение в термодинамике необратимых процессов имеет величина, численно равная скорости увеличения энтропии в единице объема:
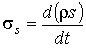 . . | (4.85) |
Если в качестве термодинамических параметров системы выступают 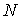 величин 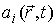 , то формулу (4.85) можно представить в виде:
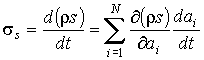 . . | (4.86) |
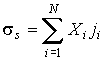 . . | (4.87) |
В случае небольших отклонений от равновесного состояния между термодинамическими потоками 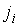 и термодинамическими силами 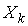 может быть установлена линейная зависимость
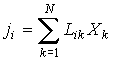 . . | (4.88) |
Таким образом, для линейных необратимых процессов производство энтропии определяется выражением
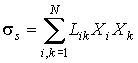 | (4.89) |
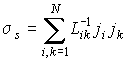 . . | (4.90) |
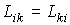 , , | (4.91) |
Стационарные необратимые процессы протекают таким образом, чтобы производство энтропии было минимальным.
Принцип минимума производства энтропии позволяет установить критерий отбора реализующихся в природе необратимых процессов от реально не наблюдающихся, и, таким образом, выбрать из возможных процессов реально существующие.
Необходимость выполнения указанного принципа приводит к тому, что при протекании в среде необратимых стационарных процессов возникают динамические структуры, названные Пригожиным диссипативными структурами, что уменьшает производство энтропии. Примером таких структур могут служить ячейки Бенара - регулярные динамические структуры, возникающие в тонком слое нагреваемой снизу жидкости, и колебательные химические реакции Б.П. Белоусова, при которых происходят периодические изменения концентрации реагирующих веществ.
|